系のはじめの状態と終わりの状態が同じとなる変化をサイクルとよびますが、そのサイクルの中で最も有名であると言えるカルノーサイクルについて演習問題を通して学習してみましょう。
カルノーサイクルの熱効率
例題1
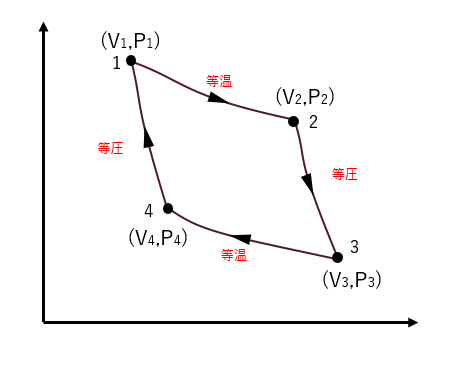
\(\)左図のように状態1から2は温度\(T_H\)の高熱源による等温膨張、状態2から3は断熱膨張、状態3から4は温度\(T_L\)の低熱源による等温収縮、状態4から1は断熱収縮となる理想気体の準静的なカルノーサイクルを考える。
⑴等温膨張時に受け取った熱量を\(Q_H\)、等温収縮時に失った熱量を\(Q_L\)とすると、以下の等式が成り立つことを示せ。
ただし等温変化において内部エネルギーが変化しないことを用いよ。(ジュールの法則)
$$\frac{Q_H}{T_H}=\frac{Q_L}{T_L}$$
⑵このサイクルの熱効率\(\eta\)を\(Q_H\)と\(Q_L\)を用いて表せ。
解答
⑴ジュールの法則より等温変化では内部エネルギーが変化しないから熱力学第一法則より、
状態1から2および状態3から4において気体が受け取る熱と気体のする仕事が等しくなる。
ゆえに理想気体の状態方程式\(PV=nRT\)から、
$$\begin{eqnarray}Q_H &=& \int_{V_1}^{V_2} PdV \\ &=& nRT_H\int_{V_1}^{V_2} \frac{dV}{V}=nRT_Hlog\frac{V_2}{V_1}\end{eqnarray}$$
$$\begin{eqnarray}Q_L &=& -\int_{V_3}^{V_4} PdV \\ &=& -nRT_H\int_{V_3}^{V_4} \frac{dV}{V}=nRT_Llog\frac{V_3}{V_4}\end{eqnarray}$$
よって、
$$\frac{Q_H}{T_H}=nRlog\frac{V_2}{V_1},\frac{Q_L}{T_L}=nRlog\frac{V_3}{V_4}$$
が成り立つ。
ここで状態2から4、状態4から1が断熱変化であるからポアソンの式より、\(C_P/C_V=\gamma\)を用いて、
$$T_HV_2^{\gamma-1}=T_LV_3^{\gamma-1},T_HV_1^{\gamma-1}=T_LV_4^{\gamma-1}$$
と書け、これにより
$$\frac{V_2}{V_1}=\frac{V_3}{V_4}$$
よって
$$\frac{Q_H}{T_H}=\frac{Q_L}{T_L}=nRlog\frac{V_2}{V_1}$$
は成り立つ。
⑵
熱効率とは加えた熱量に対してどれくらい仕事をしたかであるから、
$$\eta=\frac{W}{Q_{in}}$$
状態1から始まり状態1に戻るまでの間の内部エネルギーの変化の総和は0かつ受け取った熱量の総和は\(Q_H-Q_L\)であるから、熱力学第一法則より、
$$W=Q_H-Q_L$$
ゆえに熱効率は
$$\eta=\frac{Q_H-Q_L}{Q_H}=1-\frac{Q_L}{Q_H}$$
よって⑴の等式を代入すると、
$$\eta=1-\frac{T_L}{T_H}$$
となる。
カルノーの定理の証明
例題2
⑴任意の可逆なサイクルの熱効率が理想気体のカルノーサイクルの熱効率\(\eta=1-\frac{T_L}{T_H}\)に等しいことを示せ。
ただし、
系がサイクルを行って、低温の物体から熱を受け取り、高温の物体にこの熱を与える以外に何も変化を残さないようにすることが不可能であるという原理(クラウジウスの原理)を用いよ。
⑵不可逆なサイクルの熱効率が任意の可逆なサイクルの熱効率より小さくなることを示せ。
解答
今回重要となる考え方は2つのサイクルの比較を行うためにそのサイクルを連結させて一つのサイクルと考えてクラウジウスの原理を用いることです。連結させることで2つのサイクルの熱の出入りを比較し熱効率を比較することが可能になります。
⑴理想気体のカルノーサイクルをC、任意の可逆なサイクルとその逆サイクルをそれぞれD、D’とする。
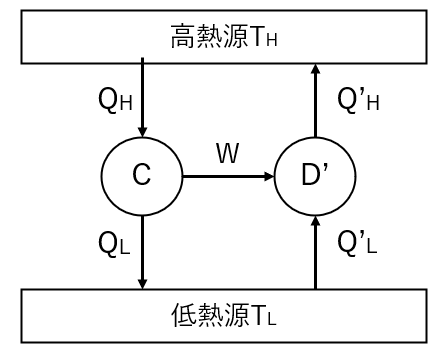
左図のような高熱源から熱を受け取ってカルノーサイクルを動かし、カルノーサイクルで生まれた仕事\(W\)で任意の可逆な逆サイクル\(D’\)を動かす状況を考える。
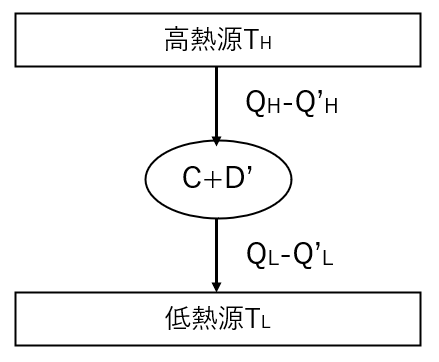
サイクル\(C\)および\(D\)をまとめて1つのサイクルと考えると、左図のようなサイクルになるから、このサイクルにクラウジウスの原理を用いると以下の式が成り立つ。
$$Q_H\geq Q’_H\cdots②$$
また熱力学第一法則より
$$Q_H-Q’_H=Q_L-Q’_L\cdots②$$
が成り立つ。
また、C、D’は可逆なサイクルより真逆にサイクルを動かすことができるから、
同様にしてクラウジウスの原理を用いると、
$$Q_H\leq Q’_H\cdots③$$
ゆえに式①かつ③より、
$$Q_H=Q’_H\cdots④$$
式②と式④から
$$Q_L=Q’_L\cdots⑤$$
サイクル\(C\)と\(D\)の熱効率をそれぞれ\(\eta\)、\(\eta ‘\)とすると、式④かつ⑤から
$$\begin{eqnarray}\eta &=& 1-\frac{Q_L}{Q_H} \\ &=& 1-\frac{Q’_L}{Q’_H}=\eta ‘\end{eqnarray}$$
が成り立つ。ゆえにカルノーサイクルと任意の可逆なサイクルの熱効率は等しくなる。
⑵不可逆なサイクルを\(E\)とする。
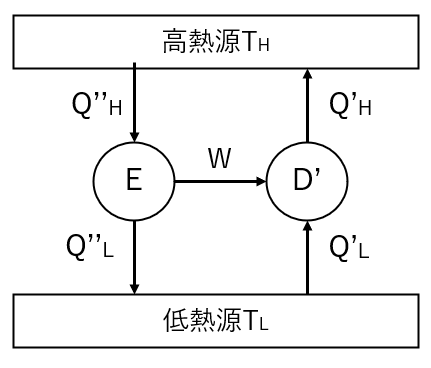
左図のように不可逆なサイクル\(E\)を動かし、生じた仕事\(W\)で逆サイクル\(D’\)を動かす状況を考える。
⑴と同様にクラウジウスの原理を用いると、
$$Q”_H\gt Q’_H\cdots⑤$$
可逆なサイクル\(D\)と不可逆なサイクル\(E\)の熱効率をそれぞれ\(\eta ‘\)、\(\eta ”\)とすると、
$$\eta ‘=\frac{W}{Q’_H},\eta ”=\frac{W}{Q”_H}$$
が成り立つ。ゆえに式⑤より
$$\eta ‘ \gt \eta ”$$
となるから、不可逆なサイクルの熱効率は可逆なサイクルの熱効率より小さくなる。



コメント