本記事では熱力学でまず学習する法則である熱力学第1法則についてのその内容について解説します。
内部エネルギーとはなにか
熱力学第1法則を理解するためには内部エネルギーがなにかを理解することが重要になります。
熱力学において内部エネルギーとは系の全エネルギーのことを指します。
化学的に見れば系は原子やイオン、分子により構成され、それらの運動エネルギーとポテンシャルエネルギーの合計が内部エネルギーになるのです。
熱力学第1法則とは
\(\)閉鎖系において最初の状態1(内部エネルギー\(U_1\))から系に\(W\)の仕事がなされ、\(Q\)の熱量が加えられて最後の状態2(内部エネルギー\(U_2\))へと変化する場合以下の等式が成り立ち、これを熱力学第1法則とよびます。
$$U_2-U_1=W+Q$$
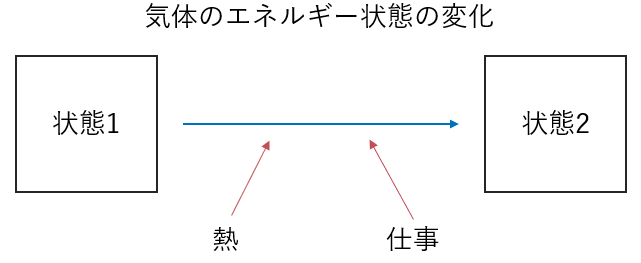
熱力学第1法則の意味
この式から分かる通り内部エネルギーの変化量が仕事と熱量の和に等しいことを示すことから、熱力学第1法則は系のエネルギーが保存することを表現したものになります。
微小な内部エネルギーにたいしては以下の式が成り立ちます。
$$dU=d’W+d’Q$$
ここで\(dU\)は経路に依存せず始状態と終状態によってのみ決定される一方で、\(d’W\)と\(d’Q\)は経路に依存することから\(‘\)をつけて区別しています。
\(d’W\)は系になされた仕事であり、系が\(d’W\)の仕事をするとき符号が逆になります。同様に\(d’Q\)は系に加えられた熱量であり、系から\(d’Q\)の熱量が放出される場合符号が逆転します。
このことはエネルギー保存の観点から感覚的にわかると思います。
この熱力学第1法則を利用することで今後学習するピストン内の断熱操作や等温操作の計算が可能になるのです。
準静的過程とは
系の状態変化が、系と外界ともに常に熱平衡状態に無限に近い状態の連続による変化であり逆にたどることができる操作のことを準静的過程と呼びます。
準静的過程でない場合熱力学第1法則のみでは系の状態を計算できないことに注意しましょう。
今後の記事でも解説しますがピストン内の断熱操作や等温操作も準静的過程に該当します。



コメント