本記事では系内で反応が起こる場合や系に物質が出入りするような系内の物質量が変化する状況において大事になる化学ポテンシャルについて紹介し解説します。
部分モル量と化学ポテンシャルの定義
まず化学ポテンシャルの意味を知るために部分モル量と化学ポテンシャルの定義について紹介します。\(\)
部分モル量とはある状態量\(X\)(\(T,P,n\)など)について以下の式が成り立つ量\(\bar{X_i}\)を部分モル量とよびます。
$$\bar{X_i}=\left(\frac{\partial X}{\partial n_i}\right)_{T,P,n_j(j\neq i)}$$
とくに\(X=G\)のときの\(\bar{G_i}\)を\(\mu_i\)と書き、化学ポテンシャルとよびます。
この化学ポテンシャルが系内で反応が起こる場合の反応の方向を評価するときなどで役に立ち、次の項ではその活用方法について解説します。
一成分系における反応の方向
化学ポテンシャルが反応の方向を決定する際に役に立つ例として、物質が相変化するときの反応の方向について考えてみましょう。
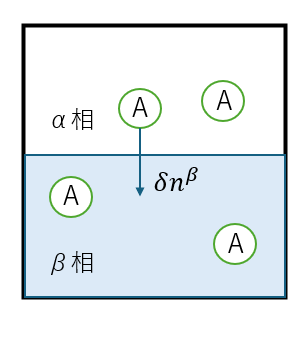
左図のような等温等圧な系のなかに物質Aによってできる2つの相(水と水蒸気など)が存在する状況を考えます。
このときのギブスの自由エネルギーについて最初の状態では以下の式が成り立ちます。
$$G=G^{\alpha}+G^{\beta}=n^{\alpha}{\mu}^{\alpha}+n^{\beta}{\mu}^{\beta}$$
この系で\(\alpha\)相から\(\beta\)相へ物質Aが\(\delta n^{\beta}\)だけ移動する場合を考えます。
このとき\(\beta\)相では\(\delta n^{\beta}\)だけ増えたとすると、
系全体の物質量\(n=n^{\alpha}+n^{\beta}\)は等しいから、
$$\delta n^{\alpha}=-\delta n^{\beta}$$
が成り立ちます。そのため系全体のギブスの自由エネルギーの変化\(\delta G\)は、
$$\begin{eqnarray}\delta G &=& \delta G^{\alpha}+G^{\beta} = {\mu}^{\alpha}\delta n^{\alpha}+{\mu}^{\beta}\delta n^{\beta} \\ &=& ({\mu}^{\beta}-{\mu}^{\alpha})\delta n^{\beta} \end{eqnarray}$$
等温等圧な系の自発変化の方向は、\(\delta G\lt 0\)であるから、
⑴\({\mu}^{\alpha}\gt {\mu}^{\beta}\)のとき、\(\delta n^{\beta}\gt 0\)となるように自発変化が進む。つまり\(\alpha\)相から\(\beta\)相へ相変化する反応が進む。
⑵\({\mu}^{\alpha}\lt {\mu}^{\beta}\)のとき、\(\delta n^{\beta}\lt 0\)となるように自発変化が進む。つまり\(\beta\)相から\(\alpha\)相へ相変化する反応が進む。
という事実が得られます。
つまり、相変化においては化学ポテンシャルが高いほうから低いほうへ相変化が起こるのです。
このように化学変化や物質の出入りが起こる場合に化学ポテンシャルは変化の方向などに密接にかかわってくるのです。
開放系における熱力学の関係式
物質の出入りが生じる開放系では系内の物質量が変化するため前の記事でまとめた物質量が変化しないのを前提とした熱力学の関係式とはすこしことなった関係式の形をとります。
開放系において以下の関係式が成り立ちます。
$$(1)dG=-SdT+VdP+\mu dN \\ S=-\left(\frac{\partial G}{\partial T}\right)_{P,N},V=\left(\frac{\partial G}{\partial P}\right)_{T,N},\mu=\left(\frac{\partial G}{\partial N}\right)_{T,P}$$
$$(2)dA=-SdT-PdV+\mu dN \\ S=-\left(\frac{\partial A}{\partial T}\right)_{V,N},V=-\left(\frac{\partial A}{\partial V}\right)_{T,N},\mu=\left(\frac{\partial A}{\partial N}\right)_{T,V}$$
$$(3)dU=-PdV+TdS+\mu dN \\ P=-\left(\frac{\partial U}{\partial V}\right)_{S,N},V=\left(\frac{\partial U}{\partial S}\right)_{V,N},\mu=\left(\frac{\partial U}{\partial N}\right)_{V,S}$$
新たに変数\(N\)による項が加わった3変数の全微分の式に変わるだけです。物質量が変化する系における各状態量を求めるときにはこの関係式を活用していくのがよいでしょう。



コメント